Hlavní chemické vlastnosti půdy
Méně poučenému čtenáři by se mohlo zdát, že je nesmyslné spojovat chemické vlastnosti s biologickou složkou půdy. V dalším textu si ale (opět) ukážeme, jak je vše v půdě propojené a jak společenstvo půdních organismů i rostliny ovlivňují chemické vlastnosti půdy a naopak, jak tyto vlastnosti působí na biologii půdy. O které chemické vlastnosti se tedy jedná? Můžeme si je vyjmenovat takto: chemické prvky a sloučeniny v půdě, půdotvorné minerály a jejich zvětrávání, půdní koloidy a procesy výměny iontů, půdní reakce a její druhy, redoxní reakce v půdě, chemické vlastnosti půdní vody a půdního vzduchu atd. V našem příspěvku nemáme samozřejmě prostor věnovat se všem chemickým vlastnostem půd, poučení lze nalézt i v naší knize Živá půda (Šimek a kol., 2019). Zde se zaměříme na několik chemických vlastností, se kterými se setkává každý sedlák a které lze prakticky ovlivnit s ohledem na pěstované plodiny.
Elementární a minerální složení půdy, minerální živiny
Půda se stejně jako vše kolem nás skládá z jednotlivých chemických prvků. Základem elementárního složení půdy jsou půdotvorné horniny a minerály, z nichž se půda vyvíjí; vzhledem k pestrému horninovému pokryvu se proto jednotlivé půdy liší ve svém mineralogickém a chemickém složení. Jinými slovy půdy obsahují různá množství jednotlivých prvků včetně důležitých živin. Horniny na zemském povrchu (v zemské kůře) jsou více než z 99 % tvořeny pouhými 10 prvky: nejvíce je zastoupen kyslík (O; 47 - 53 hmotnostních procent; %), křemík (Si; 26 - 30 %), hliník (Al; 7 - 8 %) a dále v sestupném pořadí železo (Fe), vápník (Ca), draslík (K), sodík (Na), hořčík (Mg), titan (Ti) a vodík (H). Půdy mají podobné minerální složení, ale na rozdíl od hornin jsou obohacené o uhlík (C; typicky 2 - 4 %), dusík (N; 0,2 %) a síru (S; 0,1 - 0,2 %). Obohacení souvisí se životem v půdě.
V přirozených systémech je zdrojem minerální výživy rostlin samotná půda, tedy živiny uvolněné do půdního prostředí zvětráváním minerálů (dalším zdrojem, kromě dusíku většinou menším, je i voda a vzduch). V zemědělských půdách jsou významným zdrojem živin hnojiva, ať již organická nebo anorganická. Každý sedlák ví, že se hnojí dusíkem, fosforem a draslíkem (N-P-K), někdy i vápníkem a hořčíkem, občas i sírou a v zahradnictví či při pěstování některých plodin se používají i hnojiva obsahující důležité mikroživiny. Spektrum rostlinných živin zahrnuje celkem 16 prvků, které musí mít všechny rostliny k dispozici, aby mohly vytvořit svoji biomasu a aby mohly probíhat všechny fyziologické a biochemické procesy (tabulka 1). Tyto biogenní prvky se někdy rozdělují na dvě skupiny, makroprvky (s koncentrací v biomase obvykle vyšší než 1 g/kg suché biomasy; patří sem uhlík, vodík, kyslík, dusík, fosfor, draslík, hořčík, vápník, chlor a síra) a mikroprvky (obvykle s koncentrací nižší než 0,1 g/kg; k nim se řadí železo, měď, bor, molybden, mangan a zinek). Rostliny ovšem přijímají, a tedy obsahují ve svých tkáních, i řadu dalších prvků, z nichž některé sice nejsou nezbytné, ale mohou být různým způsobem prospěšné (např. křemík, sodík, hliník, kobalt, nikl aj.). Uhlík, vodík a kyslík získávají rostliny a jiné autotrofní organismy z oxidu uhličitého (CO2) a vody (H2O). Dusík tvoří téměř ze 79 % atmosféru Země a atmosférický dusík je primárním zdrojem N pro organismy na Zemi. Primárním zdrojem všech ostatních rostlinných živin jsou půdotvorné minerály. Zvyšováním požadavků na růst výnosů plodin vzniká v zemědělských půdách deficit jednotlivých živin, které se musí dodávat hnojením. Pokud je však některá živina v půdě ve velkém nadbytku, stává se toxickou, nehledě na to, že se v takovém případě značný podíl dostává do okolního prostředí a znečisťuje jej; to platí např. pro fosfor a dusík.
|
Prvek (značka) |
Hlavní zdroj |
Rozpustná forma |
|
dusík (N) |
atmosféra (fixace N2), rozklad organické hmoty, zvětrávání minerálů (slíd, vermikulitu), výměna iontů |
NH4+, (NO3-) |
|
fosfor (P) |
rozklad organické hmoty, rozklad a rozpouštění fosfátů |
H2PO4-, HPO42- |
|
síra (S) |
rozklad organické hmoty, oxidace sulfidů, rozpouštění sádrovce |
SO42-, S2- |
|
draslík (K), hořčík (Mg), vápník (Ca) |
zvětrávání a rozpouštění křemičitanů, výměna kationtů, rozpouštění uhličitanů a síranů |
K+, Ca2+, Mg2+ |
|
železo (Fe), mangan (Mn) zinek (Zn), měď (Cu) |
rozpouštění hydroxidů, desorpce z oxidů, uvolňování z chelátů, výměna kationtů |
kationty a rozpustné cheláty |
|
bór (B), molybden (Mo) |
desorpce z jílových minerálů |
H3BO3, MoO42- |
Tabulka 1. Nejdůležitější minerální živiny rostlin, jejich zdroje v půdě a přijatelné formy pro rostliny a mikroorganismy. Půdní mikroorganismy jsou zvláště významné v zajišťování zásoby dusíku (fixací N2 a rozkladem organické hmoty OH), fosforu (rozkladem OH a rozpouštěním fosfátů), síry (rozkladem OH) ale i dalších živin (uvolňováním do půdy organických kyselin a jiných látek napomáhajících rozpouštění a rozkladu řady minerálů). (zdroj Ellis a Mellor, 1995)
Jaký je obsah živin v našich půdách a kolik živin se dodává hnojením? Je to samozřejmě různé, podle půdy, jejího využívání atd. (tabulka 2). Současná spotřeba minerálních hnojiv v ČR je kolem 135 - 140 kg čistých živin na hektar tzv. obhospodařované zemědělské půdy. V hospodářském roce 2018/19 to bylo 135 kg, z čehož připadalo 101 kg na N, 20 kg na P2O5 a 14 kg na K2O (Český statistický úřad, 2020). Úroveň hnojení dusíkem v minerálních hnojivech je příliš vysoká (nahrazuje dříve běžný přísun N do půd ve formě dusíku fixovaného jetelovinami i přísun N v organických hnojivech) a odhaduje se, že průměrný nežádoucí přebytek dusíku činí asi 40 kg N/ha (viz Budňáková, 2018). Přebytečný dusík z půd uniká a znečisťuje vodu i vzduch! Naproti tomu je celková úroveň hnojení fosforem a draslíkem v minerálních i organických hnojivech z hlediska dosahované produkce i zásobenosti půdy nedostatečná. Vyhnojit fosforem by potřebovalo asi 54 % a draslíkem asi 35 % výměry půdy v ČR (Smatanová a kol., 2017). Velkým problémem je nedostatek organických hnojiv. Za závažný jev považujeme stálý pokles obsahu přístupného vápníku v půdě. Je to vlivem naprosto nedostatečného vápnění, které ilustrují tyto údaje: zatímco v letech 1988 - 1990 se aplikovalo 2200 - 2500 tis. tun vápence, v roce 1997 jen 300 tis. tun a v současnosti je to pouze kolem 450 - 550 tis. tun ročně, tj. méně než 25 % dřívějšího vápnění (Český statistický úřad, 2020).
|
Varianta |
Dávka N |
Dávka P |
Dávka K |
Odběr N |
Odběr P |
Odběr K |
Výnos (t/ha) |
|
kontrola |
0 |
0 |
0 |
71,1 |
14,5 |
40,4 |
4,3 |
|
hnůj |
0 |
0 |
0 |
78,3 |
16,7 |
45,1 |
4,8 |
|
N1P1K1 |
60 |
30 |
40 |
125,1 |
22,8 |
69,6 |
6,6 |
|
N2P2K2 |
90 |
60 |
80 |
140,9 |
24,8 |
76,9 |
6,8 |
|
N3P3K3 |
120 |
120 |
160 |
154,1 |
25,4 |
85,6 |
6,8 |
Tabulka 2. Průměrné dávky živin v minerálních hnojivech (kg/ha), průměrný roční odběr živin pšenicí ozimou (kg/ha) a průměrný výnos zrna (t/ha) v bramborářské výrobní oblasti během 40 let dlouhodobého polního pokusu ÚKZÚZ. Nejsou započítány atmosférické vstupy, biologická fixace N2 a organické hnojení (což ovšem tuto bilanci zkresluje). Z tabulky např. vyplývá známý poznatek, že zvýšeným dávkám minerálních hnojiv neodpovídá nárůst výnosu – čím více hnojiv se aplikuje, tím je jejich efekt na výnos nižší až žádný. (zdroj Smatanová a kol., 2017).
Půdní reakce
Půdní reakce (pH) je asi nejčastěji měřenou chemickou charakteristikou půdy. Za neutrální se považuje roztok o pH = 7. Roztoky s nižším pH jsou kyselé, obsahují více iontů H+, a roztoky s vyšším pH jsou zásadité, obsahují méně iontů H+ než roztok neutrální. Protože jde o dekadický logaritmus, vyplývá z definice pH, že snížení či zvýšení pH o jednotku znamená desetinásobné zvýšení či snížení koncentrace (aktivity) iontů H+. I na pohled malá změna pH půdy, např. z 6,0 na 5,5, tedy upozorňuje na významnou změnu v chemických poměrech v půdě, na to je třeba pamatovat. Proč je pH půdy tak důležité, že se často zjišťuje? Je tomu tak mj. proto, že mnoho chemických a biologických procesů v půdě závisí na koncentraci vodíkových kationtů H+ (resp. iontů H3O+; pro zjednodušení se používá formální zápis H+) a hydroxylových aniontů OH−. Množství těchto iontů ovlivňuje rozpustnost (a tím přístupnost pro rostliny i mikroorganismy) mnoha živin, např. železa, manganu, zinku, hořčíku aj. Při velmi vysoké koncentraci H+ (kyselá reakce) se zvyšuje rozpustnost hliníku, železa nebo manganu, které se tak mohou stát toxickými pro rostliny a mikroorganismy, zatímco je omezená dostupnost vápníku a molybdenu. Naopak při vysoké koncentraci OH- (alkalická reakce) se rozpustnost některých prvků (např. zinku, boru či mědi) silně snižuje a organismy mohou trpět jejich nedostatkem. V našich přírodních podmínkách při převažujícím hospodaření se většina změn půdní reakce týká okyselování půdy, málokdy jde o její alkalizaci. Musíme zde upozornit i na to, že rozeznáváme tři druhy půdní reakce: aktivní, výměnnou a reziduální (zbytkovou), a to i proto, že aktivní a výměnná reakce se někdy zaměňují. Výměnná reakce se stanovuje například při agrochemickém zkoušení zemědělských půd (více viz Šimek a kol., v tisku).
Kyselost (aciditu) půdního roztoku způsobují hlavně kationt vodíku (H+) a hliník, v silně kyselých půdách s pH pod 5,0 pak zejména hliník, který se vyskytuje ve formě kationtů Al3+ a Al(OH)2+. Ionty hliníku v půdním roztoku reagují s vodou (hydrolyzují), a tím se do prostředí uvolňují vodíkové kationty snižující pH (obrázek 1). V půdě se ionty vyskytují jednak v půdním roztoku, jednak jsou vázané na půdních koloidech v sorpčním komplexu (o tom bude ještě řeč dále). V neutrálních a alkalických půdách s pH nad 7 dominují na výměnných místech půdních koloidů ionty Ca2+, Mg2+ a další bazické kationty, které nahradily původní ionty Al a H+. V těchto půdách byla většina iontů hliníku uložena v průběhu půdotvorných procesů do nerozpustného minerálu gibsitu. Fyzikálně-chemické mechanismy, jimiž se utváří určité pH půdního prostředí, nejsou nijak triviální a jsou podrobně vysvětleny v knize Živá půda (Šimek a kol., 2019). Důležité je to, že půdní reakci mění i řada biologických procesů. Hlavní „okyselující“ efekt má rozklad organické hmoty na jednodušší látky včetně organických kyselin až na CO2, dále příjem amoniakální formy N kořeny a oxidace dusíkatých a sirných sloučenin na sírany a dusičnany, respektive na kyselinu sírovou a dusičnou. Půdní reakci naopak zvyšuje například mikrobiální denitrifikace (redukce dusičnanů na N2O a N2), příjem nitrátové formy N a hydrolýza močoviny (příkladem jsou pastevní půdy ovlivněné močí dobytka, v nichž často zjišťujeme nárůst pH).
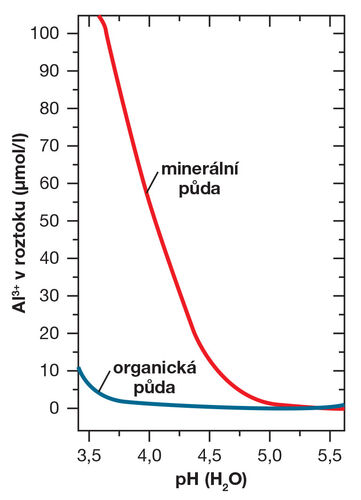 Obrázek 1. Vztah mezi obsahem hliníku ve formě nežádoucího a toxického aniontu Al3+ v půdním roztoku a půdní reakcí. Množství Al3+ se v minerální půdě zvyšuje exponenciálně s poklesem pH. Organická hmota tlumí tento nepříznivý jev, v organických půdách s vysokým obsahem organické hmoty se toxický Al téměř nemobilizuje. (zdroj Brady a Weil, 2014; grafické zpracování L. Novotná)
Obrázek 1. Vztah mezi obsahem hliníku ve formě nežádoucího a toxického aniontu Al3+ v půdním roztoku a půdní reakcí. Množství Al3+ se v minerální půdě zvyšuje exponenciálně s poklesem pH. Organická hmota tlumí tento nepříznivý jev, v organických půdách s vysokým obsahem organické hmoty se toxický Al téměř nemobilizuje. (zdroj Brady a Weil, 2014; grafické zpracování L. Novotná)
Význam půdní reakce je v tom, že kromě již výše zmíněného vlivu na rozpustnost, mobilitu a biologickou dostupnost živin ale i potenciálně rizikových prvků, má přímý i nepřímý vliv na řadu vlastností a procesů v půdě, zejména na půdní strukturu (příznivější struktura půdy se vytváří při neutrální až slabě alkalické reakci díky převažujícím dvojmocným kationtům Ca2+ a Mg2+), na ostatní chemické vlastnosti půdy, jako jsou sorpční charakteristiky (viz dále), na přeměny půdní organické hmoty a kvalitu humusu, na průběh půdotvorných procesů (například zatímco podzolizace u podzolů probíhá při silně kyselé reakci, illimerizace u luvisolů převážně při slabě kyselé reakci, soloncování u slanců je naopak spojeno s reakcí silně alkalickou a na živou složku půdy. Při kyselé reakci dochází k celkovému snížení mikrobiální aktivity, zpomalení přeměn půdní organické hmoty a ke změně složení mikrobiálních společenstev, například ubývá bakterií a naopak se relativně zvyšuje zastoupení hub. Půdní reakce má vliv i na rostliny, a to jak přímo, v závislosti na požadavcích a toleranci či citlivosti jednotlivých skupin, druhů a kultivarů rostlin ke kyselosti nebo alkalitě, tak i nepřímo ovlivněním fyzikálně-chemických procesů. Podle předních českých odborníků je optimální reakce (výměnné pH) lehkých půd v rozsahu 5,5 - 6,0, středních půd 6,0 - 6,5 a těžkých půd okolo 7,0 (Vaněk a kol., 2001).
Většina půd má tendenci přirozeně se okyselovat, a to řadou mechanismů (Šimek a kol., 2019). Přirozená acidifikace doprovázená ztrátou bazických kationtů vyplavením z půd (obrázek 2) nebo jejich asimilací do biomasy je za normálních okolností částečně kompenzována dalším zvětráváním hornin a rozkladem odumřelé vegetace. V agroekosystémech je ale značná část biomasy opakovaně a dlouhodobě odnášena ve sklízených produktech, a tím se půda ochuzuje o podstatné množství kationtů důležitých pro neutralizaci kyselin v půdě. Analogicky působí těžba dřevní hmoty v lesích na lesní půdy a ekosystémy. Odnos biomasy ze systému má tak při zemědělském a lesnickém využívání za následek prohlubování acidifikace, kterou podporuje i používání průmyslových hnojiv (např. hnojiv obsahujících NH4+, viz dále, obrázek 4). Přirozené okyselování zesiluje člověk, jednak pěstováním plodin a hnojením, jednak produkcí polutantů, které se dostávají do atmosféry a posléze jako tzv. kyselé depozice i do půdy.
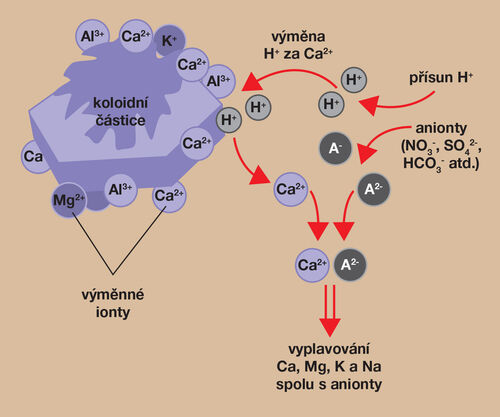 Obrázek 2. Při zvýšeném přísunu vodíkových kationtů dochází mj. k vytěsňování a náhradě H+ za bazické kationty Ca2+, Mg2+ a další na vazebných pozicích půdní koloidů. Kationty uvolněné do půdního roztoku jsou ve zvýšené míře vyplavovány spolu s anionty a půda se o ně ochuzuje. Výměnné pozice sorpčního komplexu půdy obsadí ionty H+ a Al3+, které dominují i v půdním roztoku a půda vykazuje kyselou reakci. Tento mechanismus acidifikace probíhá v dostatečně vlhkém klimatu při promyvném režimu půd; v aridních podmínkách k vyplavování bazických iontů a tím ani k acidifikaci takto nedochází. (zdroj Brady a Weil, 2014; grafické zpracování L. Novotná)
Obrázek 2. Při zvýšeném přísunu vodíkových kationtů dochází mj. k vytěsňování a náhradě H+ za bazické kationty Ca2+, Mg2+ a další na vazebných pozicích půdní koloidů. Kationty uvolněné do půdního roztoku jsou ve zvýšené míře vyplavovány spolu s anionty a půda se o ně ochuzuje. Výměnné pozice sorpčního komplexu půdy obsadí ionty H+ a Al3+, které dominují i v půdním roztoku a půda vykazuje kyselou reakci. Tento mechanismus acidifikace probíhá v dostatečně vlhkém klimatu při promyvném režimu půd; v aridních podmínkách k vyplavování bazických iontů a tím ani k acidifikaci takto nedochází. (zdroj Brady a Weil, 2014; grafické zpracování L. Novotná)
Opatření ke snížení acidifikace
Opatření zahrnují v první řadě snižování emisí a depozic okyselujících látek, dále pak biologická a agrotechnická opatření a chemické úpravy půd. Běžná opatření představují v případě zemědělských půd například omezené zpracování půdy (sníží se mineralizace a nitrifikace), výběr a střídání plodin (vede k rovnoměrnějšímu odčerpání živin z půdy) a ponechávání posklizňových zbytků na poli resp. v půdě. Zvýšením obsahu organické hmoty, zejména v kompostované formě s dostatkem bazických kationtů, je možné snížit toxicitu hliníku vytvořením komplexů s organickými látkami. Dobré hospodaření s organickou hmotou vede v kyselých půdách také ke zlepšení přístupnosti fosforu a udržení vysoké hodnoty kationtové výměnné kapacity.
Chemická meliorace spočívá v aplikaci hnojiv a dalších látek za účelem udržení či zvýšení pH půdy a zásoby živin. Hlavním melioračním opatřením je vápnění půd, tradiční a osvědčené zúrodňující opatření, které se u nás v současnosti ignoruje, respektive nevyužívá zdaleka tak často, jak by bylo třeba, jak jsme uvedli výše. Vápenatá a vápenatohořečnatá hnojiva se ovšem používají nejen k regulaci půdní reakce, ale i k doplnění úbytku vápníku a hořčíku v půdě a k optimalizaci půdního sorpčního komplexu (viz dále). Dávka vápenatého hnojiva se stanovuje podle pH, druhu půdy a pěstované kultury a je součástí doporučení po rozboru půdy (AZZP; více např. Trávník a kol., 2020). Maximální jednorázové dávky vápnění jsou pro lehké půdy asi 1,5 t CaO/ha, pro střední půdy 3,0 t CaO/ha a pro těžké půdy 5,0 t CaO/ha (dávka mletého vápence je cca dvakrát vyšší než dávka CaO, tedy např. 3 t vápence/ha lehké půdy). Neutralizační efekt vápence spočívá v jeho reakci s vodou, při níž se uvolňují ionty OH−, které reagují s nadbytečnými ionty H+ a tak je neutralizují: CaCO3 + H2O ® Ca2+ + HCO3− + OH−.
Půdní koloidy
Termínem koloid se označuje stav látky, který je dán velikostí částic a jejich diskontinuitou. Částice koloidů mají vzhledem ke své malé velikosti velký měrný povrch: vnější kolem 10 m2/g, vnitřní povrchy např. jílových částic tvořených jílovými minerály v půdě jsou 500–700 m2/g i více. Povrchy půdních koloidů obvykle nesou negativní (záporný) nebo řidčeji pozitivní (kladný) náboj, na který poutají ionty opačného náboje. Jednotlivé koloidní částice v půdě mohou poutat stovky až tisíce kationtů jako jsou Ca2+, Mg2+, Al3+, H+ apod. (viz obrázek 2). Spolu s adsorbovanými kationty poutají koloidní částice velké množství molekul vody. Některé jsou adsorbovány přímo na površích koloidů podobně jako kationty, jiné jsou přitahovány adsorbovanými hydratovanými kationty.
Půda obsahuje velmi mnoho různých látek v koloidním stavu; minerální koloidy zahrnují především jílové částice (tvořené sekundárními jílovými minerály), dále oxidy železa, manganu a hliníku a polymerní kyselinu křemičitou. V půdním prostředí se nachází i mnoho organických látek v koloidním stavu včetně meziproduktů rozkladu rostlinných zbytků, látek humusové povahy a polymerů, jako jsou lignin, bílkoviny nebo polysacharidy. Vlastnosti koloidů vykazují také buněčné stěny a protoplasma organismů. Koloidy ve formě gelu mohou peptizací přecházet v sol (= koloidní roztok). V půdě je tento jev většinou považován za nepříznivý, neboť vede k rozpadu (rozplavení) půdní struktury; peptizace je podporována např. větším podílem iontů NH4+ a Na+ a nízkou koncentrací půdního roztoku. Opačným procesem je koagulace solu v gel, tedy shlukování jednotlivých koloidních částic, což vede k tvorbě agregátů a zlepšení půdní struktury. Koagulaci podporují dvojmocné (zejména Ca2+, Mg2+) a další vícemocné kationty, a také vyšší koncentrace půdního roztoku. Koagulace se tak zvyšuje i při vymrzání a vysychání půdy. Značný význam koloidů v půdě plyne zejména z toho, že zabezpečují půdě dynamické vlastnosti: ovlivňují změny pH a koncentraci iontů, změny vlhkosti a teploty, mění svůj stav a tedy stav celé půdy procesy peptizace a koagulace, ovlivňují všechny agronomické a technologické vlastnosti půd (vodní a vzdušný režim, tepelný režim, zpracovatelnost půdy, kapilární jevy – vzlínání vody atd.), sorbují a uvolňují ionty, což má zcela zásadní význam pro výživu rostlin i mikroorganismů i pro chování cizorodých látek a škodlivin v půdě. Koloidy se také podílejí na řadě půdotvorných procesů (Šimek a kol., v tisku).
Půdní sorpční komplex
Půdní sorpční komplex zajišťuje hlavně sorpci fyzikálně-chemickou, kdy dochází k výměně iontů mezi povrchy (koloidy) a půdním roztokem v důsledku existence elektrických nábojů. Vrstevnaté jílové minerály vermikulit, montmorillonit aj. nesou vesměs negativní náboj (a tak poutají kationty). Jílové minerály skupiny kaolinitu, alofan, sesquioxidy Al a Fe a humusové látky nesou negativní i pozitivní náboje (obrázek 3). Fenomén vázání (sorpce) a uvolňování (desorpce) iontů je jeden z nejdůležitějších procesů v půdě. Z převahy negativních nábojů na většině půdních koloidů plyne, že se sorbují především kationty. Kromě jednoduchých minerálních kationtů (Ca2+, Mg2+, K+, Na+, H+, Al3+, NH4+) jsou sorbovány i nejrůznější organické sloučeniny a organo-minerální komplexy. V důsledku existence rovnováh dochází neustále mezi sorbovanými ionty a ionty v půdním roztoku k výměnám iontů (sorpci-desorpci). Výměna kationtů je vratná. Jestliže se do půdy dostanou v nadbytku kationty jako např. Ca2+ (po vápnění), nahradí sorbované ionty H+, ty jsou neutralizovány ionty OH− nebo CO32− a pH se zvýší. Analogicky snižují pH kyselinotvorné látky, jako např. sírany nebo elementární síra, dodané do alkalické půdy. Kationty prvků se nacházejí v půdě v různém stavu: obvykle je největší část kationtů pevně poutána v krystalových mřížkách minerálů (= nevýměnné kationty). Zvětráváním minerálů se vytvářejí podmínky pro vznik „potenciální zásobárny“ kationtů, které mohou být za určitých podmínek uvolněny do půdního roztoku (= výměnné kationty). Konečně část (často nejmenší) kationtů se již nachází v půdním roztoku. Přídavek kationtů do půdy, např. ve formě minerálního hnojiva, může vést k opačnému procesu – vzhledem k relativnímu nadbytku daných kationtů v půdním roztoku je část kationtů z roztoku zpětně poutána v minerálech (jako výměnná nebo dokonce nevýměnná forma). Výměnné procesy iontů mají klíčový význam pro výživu plodin i mikroorganismů v půdě. Mnoho iontů se postupně uvolňuje při rozkladu organických látek i při zvětrávání půdotvorných minerálů. Je nesmírně důležité, aby byly tyto ionty v půdě zachyceny a poutány, ovšem jen tak, aby mohly být uvolněny pro potřeby rostlin i mikroorganismů. Toto zabezpečuje právě sorpční komplex (obrázek 3).
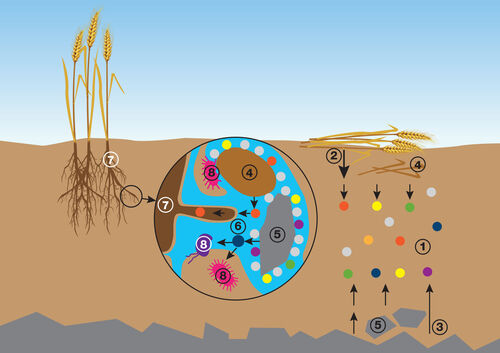 Obrázek 3. Výměnné procesy iontů v půdě. Do půdy se neustále uvolňuje velké množství iontů (1), a to jak mineralizací mrtvé organické hmoty (2), tak zvětráváním minerálů (3). Ionty jsou zachyceny a dočasně poutány sorpčním komplexem, který je tvořen organickým látkami (4) a jílovými minerály (5). Z této dočasné zásobárny jsou na principu rovnováhy a koncentračního gradientu (tj. difuze z oblasti s vyšší koncentrací do oblasti s nižší koncentrací) ionty uvolňovány zpět do půdního roztoku (6), odkud je odčerpávají kořenové buňky rostlin (7) a mikroorganismy (8). (zdroj Šimek a kol., v tisku; grafické zpracování L. Novotná)
Obrázek 3. Výměnné procesy iontů v půdě. Do půdy se neustále uvolňuje velké množství iontů (1), a to jak mineralizací mrtvé organické hmoty (2), tak zvětráváním minerálů (3). Ionty jsou zachyceny a dočasně poutány sorpčním komplexem, který je tvořen organickým látkami (4) a jílovými minerály (5). Z této dočasné zásobárny jsou na principu rovnováhy a koncentračního gradientu (tj. difuze z oblasti s vyšší koncentrací do oblasti s nižší koncentrací) ionty uvolňovány zpět do půdního roztoku (6), odkud je odčerpávají kořenové buňky rostlin (7) a mikroorganismy (8). (zdroj Šimek a kol., v tisku; grafické zpracování L. Novotná)
Součet nábojů výměnných kationtů, které může daná půda adsorbovat, se nazývá kationtová výměnná kapacita (KVK). Vyjadřuje se např. v centimolech (cmol) na kg půdy. Platí tedy např., že 1 cmol negativního náboje na 1 kg půdy může sorbovat 1 cmol pozitivního náboje, ať již patří H+, Na+, Ca2+ nebo jiným kationtům. Kationtová výměnná kapacita půdy je dána množstvím a kvalitou koloidů (jílových minerálů a organické hmoty) v půdě a půdní texturou; samozřejmě je ovlivněna i způsoby hospodaření (obrázky 4 a 5). Lehčí písčité půdy s nižším obsahem jílových minerálů i organické hmoty jsou promyvnější, více kationtů je z nich vyplavováno, snadněji se okyselují a mají nižší KVK než těžší půdy. Jílovité půdy s převahou kaolinitu a sesquioxidů v jílové frakci mají nižší KVK než půdy se stejným obsahem organické hmoty, ale s převahou jílových minerálů typu smektitu apod. Problematiku sorpčního komplexu půdy a jeho hodnocení v zemědělských půdách přehledně přibližují Khel a Vopravil (2009a,b). Pro úplnost dodejme, že v některých půdách např. v tropech se vyskytuje i velké množství koloidů s převažujícím kladným nábojem a pak se pro charakterizaci půdního sorpčního komplexu stanovuje aniontová výměnná kapacita. Ta nabývá na významu i v kyselých půdách v našich podmínkách (obrázek 6).
Kvalitní půdy v dobrém stavu mají vysokou KVK s optimálním zastoupením důležitých bazických kationtů (k nim patří zejména Ca2+, Mg2+, K+ a Na+) v sorpčním komplexu půdy; na tyto kationty by mělo připadat nejméně 70 % všech poutaných kationtů. Půda má pak schopnost průběžně zásobovat rostliny i mikroorganismy živinami. Je žádoucí, aby sorpční komplex půdy byl nejen schopen poutat velké množství kationtů, ale také aby jejich skladba byla vyvážená. Například při příliš vysoké koncentraci draslíku v půdě se podstatně snižuje dostupnost hořčíku a jeho příjem rostlinami s neblahými důsledky v růstu a vývoji rostlin a následně např. jako tzv. pastevní tetanie dobytka krmeného biomasou s malým obsahem hořčíku. Vhodným opatřením k posílení sorpčního komplexu půdy je vápnění.
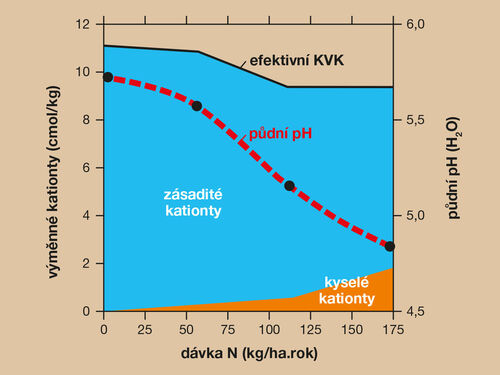 Obrázek 4. Hnojení zemědělských půd dusíkem ovlivňuje půdní prostředí. Nadměrné dávky amonné formy NH4+ podporují nitrifikaci (bakteriální konverzi na formu NO3-), při níž se uvolňuje množství iontů H+. Dochází k okyselování půdy, ke snížení kationtové výměnné kapacity (KVK) a k nárůstu koncentrace okyselujících kationtů H+ a Al3+ v půdním roztoku. Při vysokých dávkách nemohou rostliny nadbytek dusíku v půdě využít a dochází k velkým ztrátám, jak ekonomickým (zbytečné hnojení), tak environmentálním (znečistění). Na obrázku je znázorněn stav po 30 letech hnojení ve 4 různých dávkách (viz černé body na křivce pH) při pěstování kukuřice, sóji a tabáku ve Wisconsinu, USA. (zdroj Barak a kol., 1977, cit. Brady a Weil, 2014; grafické zpracování L. Novotná)
Obrázek 4. Hnojení zemědělských půd dusíkem ovlivňuje půdní prostředí. Nadměrné dávky amonné formy NH4+ podporují nitrifikaci (bakteriální konverzi na formu NO3-), při níž se uvolňuje množství iontů H+. Dochází k okyselování půdy, ke snížení kationtové výměnné kapacity (KVK) a k nárůstu koncentrace okyselujících kationtů H+ a Al3+ v půdním roztoku. Při vysokých dávkách nemohou rostliny nadbytek dusíku v půdě využít a dochází k velkým ztrátám, jak ekonomickým (zbytečné hnojení), tak environmentálním (znečistění). Na obrázku je znázorněn stav po 30 letech hnojení ve 4 různých dávkách (viz černé body na křivce pH) při pěstování kukuřice, sóji a tabáku ve Wisconsinu, USA. (zdroj Barak a kol., 1977, cit. Brady a Weil, 2014; grafické zpracování L. Novotná)
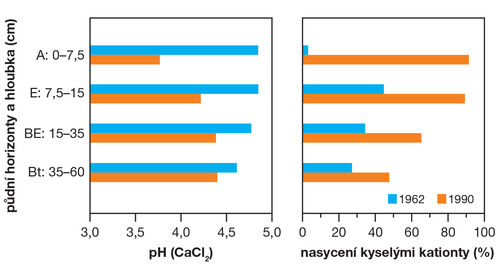
Obrázek 5. Změny v půdě na plantáži Pinus taeda (tzv. jižní žlutá borovice) v Jižní Karolíně, USA. Po cca 30 letech pěstování pokleslo pH zejména svrchních půdních horizontů a v této souvislosti se velmi výrazně zvýšil podíl kyselých kationtů v půdním sorpčním komplexu. V tomto stavu nemůže sorpční komplex zásobovat plodiny potřebnými živinami. (zdroj Markewitz a kol., 1998, cit. Brady a Weil, 2014; grafické zpracování L. Novotná)
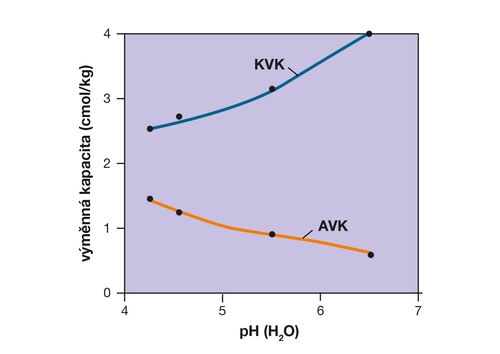 Obrázek 6. Vliv zvýšení pH půdy na sorpční komplex. Při nízkém pH obsahuje půdní sorpční komplex relativně vysoké množství aniontů (viz aniontová výměnná kapacita, AVK) a potenciál pro zásobování plodin potřebnými kationty je nízký (viz kationtová výměnná kapacita, KVK). Při navýšení pH například vápněním se kationtová výměnná kapacita podstatně zvýší a vytvoří se lepší podmínky pro výživu plodin. (zdroj Bellini a kol., 1996, cit. Brady a Weil, 2014; grafické zpracování L. Novotná)
Obrázek 6. Vliv zvýšení pH půdy na sorpční komplex. Při nízkém pH obsahuje půdní sorpční komplex relativně vysoké množství aniontů (viz aniontová výměnná kapacita, AVK) a potenciál pro zásobování plodin potřebnými kationty je nízký (viz kationtová výměnná kapacita, KVK). Při navýšení pH například vápněním se kationtová výměnná kapacita podstatně zvýší a vytvoří se lepší podmínky pro výživu plodin. (zdroj Bellini a kol., 1996, cit. Brady a Weil, 2014; grafické zpracování L. Novotná)
Naše půdy trpí degradací chemických vlastností, která je v mnoha případech natolik silná, že snižuje úrodnost, produktivitu a kvalitu půdy. Půdy poškozuje zejména:
- acidifikace, tj. snižování pH, týká se většiny půd a stále se prohlubuje,
- zmenšující se zásoba živin, hlavně fosforu a draslíku, ale i vápníku a hořčíku,
- pokles zásoby dvojmocných kationtů v sorpčním komplexu půdy a snižování kationtové výměnné kapacity,
- přehnojování dusíkem na některých orných půdách, přemíra živin na určitých lokalitách příliš zatížených pastvin,
- znečistění půdy (a následně vody a celého prostředí) pesticidy,
- pokles kvality a množství organické hmoty v půdách (viz minulý díl našeho seriálu).
 Obrázek 7. Dobrý sedlák ví, stejně jako naše chytrá kravička, že nejlepším zdrojem živin pro plodiny jsou kvalitní statková hnojiva, zelené hnojení a (v případě dusíku) jeteloviny a luskoviny v osevním postupu. Zvýšené nároky na potřebu živin při požadavku vysokých výnosů plodin je možné hradit průmyslovými hnojivy. Ta se ale musí používat velmi opatrně, se znalostí místních půdních podmínek, přednost je třeba dávat hnojivům s pomalým uvolňováním živin, dávky dělit, hnojiva zapravovat do půdy, hnojit pouze když plodiny mohou zvýšené množství živin efektivně využít atp. (námět Miloslav Šimek, výtvarník Hana Kárová)
Obrázek 7. Dobrý sedlák ví, stejně jako naše chytrá kravička, že nejlepším zdrojem živin pro plodiny jsou kvalitní statková hnojiva, zelené hnojení a (v případě dusíku) jeteloviny a luskoviny v osevním postupu. Zvýšené nároky na potřebu živin při požadavku vysokých výnosů plodin je možné hradit průmyslovými hnojivy. Ta se ale musí používat velmi opatrně, se znalostí místních půdních podmínek, přednost je třeba dávat hnojivům s pomalým uvolňováním živin, dávky dělit, hnojiva zapravovat do půdy, hnojit pouze když plodiny mohou zvýšené množství živin efektivně využít atp. (námět Miloslav Šimek, výtvarník Hana Kárová)
Zopakujme si: chemické poměry v půdě jsou velmi důležité pro plodiny i pro společenstvo půdních organismů. Většině prospívá neutrální nebo mírně kyselá reakce, při níž jsou také nejlepší podmínky pro iontovou výměnu v rámci sorpčního komplexu půdy. Zemědělským využíváním se rovnováha narušuje a půda se okyseluje. Významným a nenahraditelným opatřením je pravidelné vápnění, kterým se upravuje pH, dodávají velmi důležité dvojmocné kationty, podporuje se tvorba a zachování dobré struktury půdy a biologické procesy v půdě. Plodinami odčerpávané živiny se nahrazují uvážlivým hnojením, přičemž nejvhodnější jsou organická hnojiva a dále přísun biomasy ve vyvážených osevních postupech. Použití průmyslových vysoce koncentrovaných hnojiv je pouze doplňkové a vyžaduje znalosti a citlivý přístup, aby nedocházelo ke ztrátám živin a znečistění prostředí.
V příštím díle miniseriálu Zdravá půda – náš odkaz dalším generacím se zaměříme na fyzikální vlastnosti a charakteristiky půdy a na to, jak jsou vytvářeny nebo modifikovány půdními organismy.
Citovaná literatura
BRADY, N. C., WEILL, R. R., 2014. The nature and properties of soils (14. vydání). Harlow: Pearson, 1046 s.
BUDŇÁKOVÁ, M., 2018. Výživa rostlin a používání hnojiv v České republice. Úroda, 4, s. 58–59.
Český statistický úřad, 2020. Statistická ročenka České republiky 2020. Praha: ČSÚ, 807 s. Dostupné také online
ELLIS, S., MELLOR, A., 1995. Soils and environment. London: Routledge, 364 s.
KHEL, T., VOPRAVIL, J., 2009a. Sorpční komplex půdy. Úroda, 9, s. 64.
KHEL, T., VOPRAVIL, J., 2009b. Charakteristiky sorpčního komplexu a výměnné ionty. Úroda, 10, s. 53.
SMATANOVÁ, M., KOMPRSOVÁ, I., SUŠIL, A., 2017. Výsledky agrochemického zkoušení zemědělských půd za období 2011–2016. Brno: Ústřední kontrolní a zkušební ústav zemědělský, 111 s.
ŠIMEK, M., a kol., 2019. Živá půda: biologie, ekologie, využívání a degradace půdy. Praha: Academia, 789 s.
ŠIMEK, M., a kol., v tisku. Živá půda – praktický manuál. Praha: Academia.
TRÁVNÍK, K., a kol., 2020. Metodický návod pro hnojení plodin (6. vydání). Brno: Ústřední kontrolní a zkušební ústav zemědělský, 29 s.
VANĚK, V., BRODSKÝ, L., TLUSTOŠ, P., ZBÍRAL, J., 2001. Jak pohlížet na půdní reakci (pH) půd. [online]. Praha: Úroda, 20. 7. 2001, autor E. Kulovaná. [cit. 3. 3. 2021]. Dostupné z: https://www.uroda.cz/jak-pohlizet-na-pudni-reakci-ph-pud/.
Článek vznikl s podporou programu Akademie věd ČR Strategie AV21: Záchrana a obnova krajiny.
text: Miloslav Šimek, Biologické centrum AV ČR, v. v. i.
ilustrační foto: Gabriel Kužel